4月3日,美國、歐盟再次對進口醫療物資技術要求進行重大調整,相關企業應加強關注,保障合規產品順利出口。
一、美國允許醫療機構有條件使用符合中國標準的KN95口罩
2020年4月3日,美國食品與藥物管理局(FDA)宣布在確認滿足相關要求的前提下,將允許美國醫療機構使用中國生產的KN95口罩。FDA同時發布了新的針對非美國國家職業安全衛生研究所(NIOSH)批準的中國生產N95口罩的緊急使用授權(EUA),該緊急使用授權使得按照我國標準生產的KN95口罩只要能夠符合相應的標準要求、包括證明其為真品,可以進入美國市場。出口企業應及時下載該文件并進行詳細閱讀確保產品符合美國相關要求。
FDA個人防護裝備緊急使用授權:
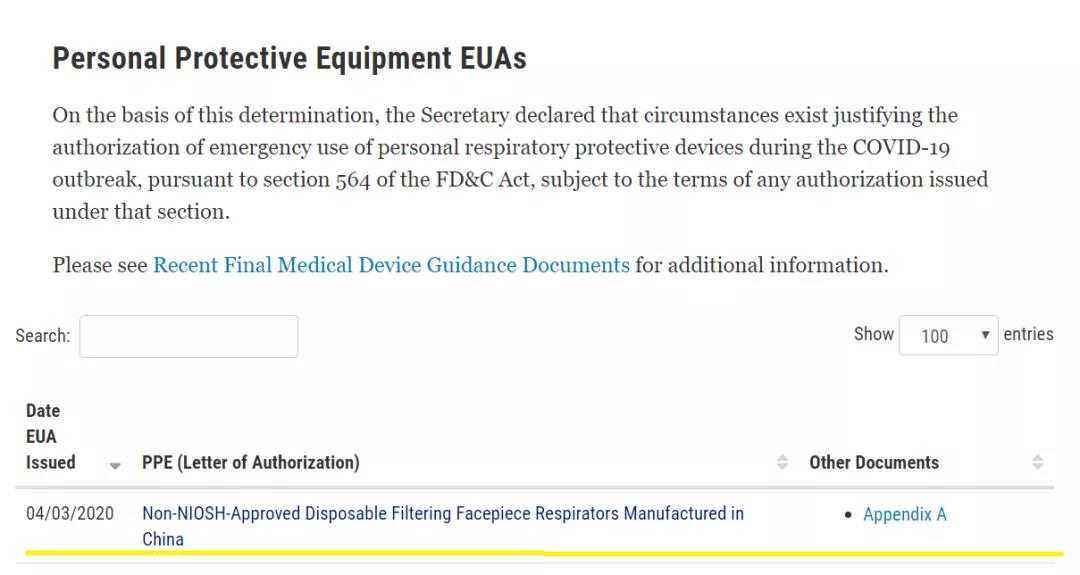
FDA 4月3日官網最新要求:

溫馨提示:
上述政策變化不涉及現有認證要求,任何情況下已經獲得FDA認證的口罩出口到美國都不會受影響。根據FDA最新發布的緊急使用授權,符合中國標準的KN95口罩可在美國醫療機構使用,但必須符合部分條件,依然存在一定不確定性。企業應充分閱讀并了解FDA相關要求并進行必要的自我評估,確保企業符合這些要求并能提交必要的證明文件。
二、歐盟通過議案,新版醫療器械法規將推遲一年實施
同在4月3日,歐盟通過議案,新版醫療器械法規(MDR)將推遲一年實施,出口企業可暫不考慮醫療器械新舊CE證書換版問題。
原文鏈接:
https://ec.europa.eu/commission/presscorner/detail/en/IP_20_589
2017年5月5日歐盟發布了新版醫療器械法規MDR(EU 2017/745)。在2017年5月25日,新版醫療器械法規正式生效。舊版醫療器械指令即MDD( 93/42/EEC)與新版醫療器械法規MDR(EU 2017/745)指令的交替過渡期為三年。按原計劃,從2020年5月26日起, 新版醫療器械法規MDR指令將在歐盟開始強制執行,它將完全取代過去舊版的醫療器械指令MDD (93/42/EEC)和舊版的有源植入醫療器械指令AIMDD(90/385/EEC)。而目前市場上最近完成的醫用口罩CE證書基本上都是基于舊版歐盟醫療器械指令MDD 93/42/EEC進行發放的,此前企業普遍擔心這部分CE證書即將面臨換版。4月3日議案正是解決了這一問題。
歐盟4月3日議案:
溫馨提示:
3月13日歐盟出臺指令(EU) 2020/403,指令中提到:在疫情期間,允許部分防疫物資(如一類滅菌的醫用口罩)在符合安全有效的情況下,即使尚未獲得CE認證,也可以在歐盟市場上市銷售,成員國主管當局也可在疫情期間評估和組織采購沒有CE標記的醫療器械,但出口企業應注意到,該指令有附加條件,即上述未獲得CE的產品僅可提供給醫療工作者使用,不能在市場上流通銷售。同時市場將會重點抽查防疫相關醫療器械,以防止不合格產品引起嚴重風險。
原文鏈接:
https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1584590666000&uri=CELEX:32020H0403
企業同樣應充分了解這些要求并進行必要的自我評估,確保在未獲得CE認證的情況下出口至歐盟的口罩符合這些要求。
三、中國口罩等防護物資出口政策的調整
3月31號晚,商務部、海關總署、國家藥品監督管理局發布了關于有序開展醫療物資出口的公告。在公告中明確,自4月1日起,出口新型冠狀病毒測試劑、醫用口罩、醫用防護服、呼吸機、紅外體溫計等醫療物資時,需要提供書面或者電子聲明,承諾出口產品有國內醫療器械證書,符合進口國(地區)的質量標準要求,并在附件中給出了醫療器械產品注冊清單。

原文鏈接:
http://www.mofcom.gov.cn/article/b/e/202003/20200302950371.shtml








